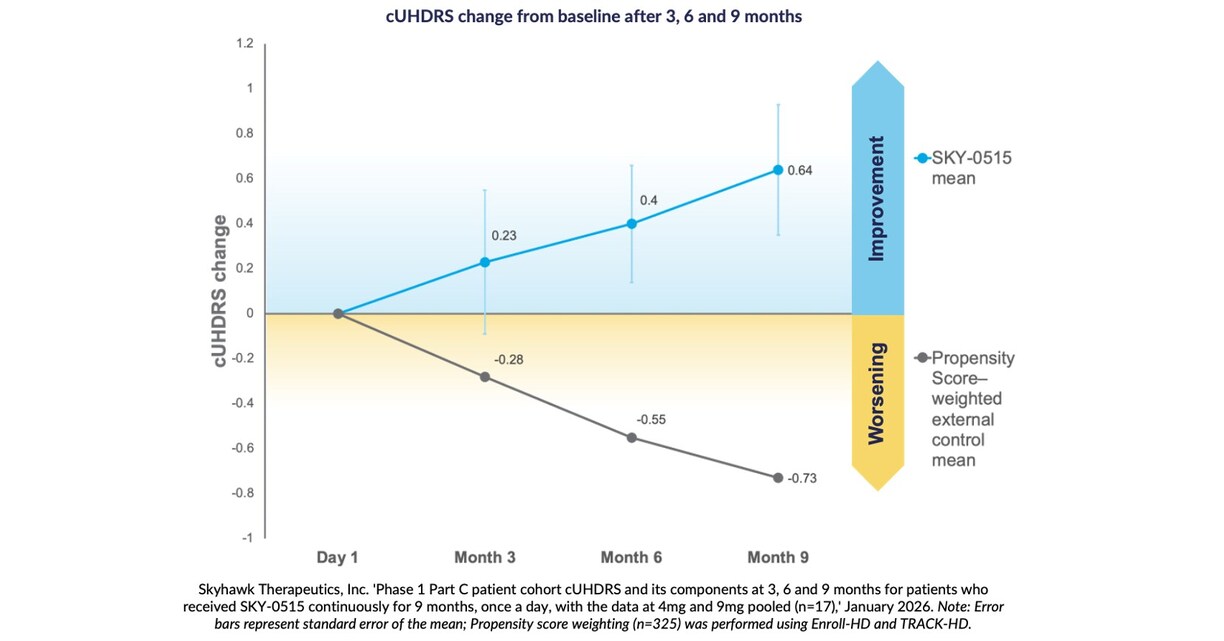
Die Ergebnisse nach neun Monaten zeigen eine durchschnittliche Verbesserung auf der Composite Unified Huntington’s Disease Rating Scale (cUHDRS) gegenüber dem Ausgangswert um +0,64 Punkte, verglichen mit einer aufgrund der natürlichen Krankheitsentwicklung zu erwartenden Verschlechterung der cUHDRS bei symptomatischen Patienten um -0,73 Punkte über neun Monate, basierend auf einer Propensity-Score-Gewichtung.
Skyhawk gibt außerdem bekannt, dass die Phase-2/3-Studie FALCON-HD für SKY-0515 weltweit ausgeweitet wurde. Skyhawk hat inzwischen mehr als 90 Patienten behandelt.
BOSTON, 28. Januar 2026 /PRNewswire/ — Skyhawk Therapeutics, Inc., ein Biotechnologieunternehmen im klinischen Stadium, das neuartige niedermolekulare Therapien zur Modulation kritischer RNA-Ziele entwickelt, gibt heute positive Ergebnisse der neunmonatigen Zwischenanalyse der Prüfbehandlung des Unternehmens für die Huntington-Krankheit (HD) mit SKY-0515 bekannt. Die Behandlung mit SKY-0515 führt zu einer dosisabhängigen Verringerung des mHTT-Proteins im Blut um 62 % bei einer Dosis von 9 mg und zu einer dosisabhängigen Verringerung der PMS1-mRNA um 26 %. PMS1 ist ein Schlüsselfaktor für die somatische CAG-Repeat-Expansion und die HD-Pathologie. SKY-0515 hat ebenfalls eine hervorragende Exposition des Zentralnervensystems gezeigt und ist im Allgemeinen sicher und gut verträglich. Nach drei, sechs und neun Monaten zeigen Patienten, die SKY-0515 in der Teil-C-Patientenkohorte der klinischen Phase-1-Studie mit SKY-0515 erhalten, eine durchschnittliche Verbesserung auf der Composite Unified Huntington’s Disease Rating Scale (cUHDRS) gegenüber dem Ausgangswert. Nach neun Monaten beträgt diese Verbesserung in einer gepoolten Analyse +0,64 Punkte im Vergleich zu einer erwarteten Verschlechterung des cUHDRS-Wertes bei symptomatischen Patienten von -0,73 Punkten nach neun Monaten, basierend auf einer Propensity-Score-Gewichtung mit Enroll-HD und TRACK-HD. „Ich bin sehr erfreut über diese Daten zur Sicherheit und frühen Wirksamkeit aus der Phase-1-Studie Teil C mit SKY-0515 bei Patienten, die bei den vorab festgelegten Analysen nach drei, sechs und neun Monaten eine Abweichung des cUHDRS vom erwarteten natürlichen Verlauf zeigen”, erklärte Ed Wild, Professor für Neurologie am University College London. „SKY-0515 reduziert weiterhin das mHTT-Protein in dem Maße, wie es bisher bei keinem anderen Therapeutikum bei Patienten nachgewiesen wurde. Klinische Daten und Biomarker-Daten zeigen, dass das Medikament in allen getesteten Dosierungen gut verträglich ist. Die Fähigkeit von SKY-0515, sowohl mHTT als auch PMS1 zu reduzieren, bietet eine wirksame Kombination zur Behandlung der Huntington-Krankheit über zwei ihrer wichtigsten pathogenen Mechanismen. Diese offenen Studienergebnisse, die in der laufenden placebokontrollierten FALCON-HD-Studie validiert werden sollen, lassen auf bedeutende Auswirkungen für Menschen erwarten, die auf der ganzen Welt mit einer Huntington-Erkrankung leben und für die eine oral verabreichte Huntingtin-senkende Behandlung wie SKY-0515 eine echte Veränderung darstellen wird.” „Unser Ziel für die Phase-1-Studie war es, die Sicherheit und Biomarker-Aktivität nachzuweisen”, erklärte Sergey Paushkin, Leiter der Forschungs- und Entwicklungsabteilung bei Skyhawk Therapeutics, „und die anhaltende Stärke der Biomarker-Reaktion von SKY-0515 in unserer neunmonatigen Zwischenanalyse der Daten – sowie die Verbesserung des potenziellen Endpunkts, cUHDRS im Vergleich zu einer Verschlechterung des cUHDRS-Wertes in den Daten zur natürlichen Krankheitsentwicklung bei Patienten – unterstreicht das Potenzial von SKY-0515 als erstklassige krankheitsmodifizierende Therapie für Huntington. Diese vorläufigen Daten stellen einen bedeutenden Meilenstein für SKY-0515 dar und unterstreichen die Leistungsfähigkeit der Plattform von Skyhawk bei der Bereitstellung erstklassiger kleiner Moleküle für schwerwiegende Erkrankungen, für die es keine zugelassenen krankheitsmodifizierenden Therapien gibt.” Die Huntington-Krankheit ist eine seltene, erblich bedingte und letztlich tödlich verlaufende neurodegenerative Erkrankung, von der in den Vereinigten Staaten mehr als 40.000 symptomatische Patienten betroffen sind; weltweit wird die Zahl der Betroffenen auf Hunderttausende geschätzt. Derzeit gibt es keine zugelassenen Behandlungen, die das Fortschreiten der Krankheit verlangsamen oder aufhalten. SKY-0515 ist ein oral zu verabreichender, niedermolekularer RNA-Modulator, der im Rahmen der neuartigen RNA-Modulierungsplattform des Unternehmens, SKYSTAR®, entwickelt wurde. SKY-0515 reduziert therapeutisch das HTT-Protein und das PMS1-Protein. PMS1 ist ein zusätzlicher Schlüsselfaktor für die somatische CAG-Repeat-Expansion und die HD-Pathologie und sollte die Vorteile der Reduzierung des mutierten HTT ergänzen. Skyhawk gab heute außerdem bekannt, dass die Phase-2/3-Studie SKY-0515 mit FALCON-HD, die an zwölf Standorten in Australien und Neuseeland läuft, weltweit ausgeweitet wurde. Skyhawk hat inzwischen mehr als 90 Patienten mit SKY-0515 behandelt. SKY-0515 ist das erste Medikament von Skyhawk, das sich in der klinischen Erprobung befindet. Skyhawk geht davon aus, dass bis Ende 2027 weitere niedermolekulare Medikamente zur Behandlung seltener neurologischer Erkrankungen, für die es keine zugelassenen krankheitsmodifizierenden Therapien gibt, in die Klinik eingeführt werden. Informationen zur klinischen Phase-1-Studie von SKY-0515Die klinische Phase-1-Studie zu SKY-0515 ist eine First-in-Human-Studie, die darauf ausgelegt ist, die Sicherheit, Verträglichkeit, Pharmakokinetik und Pharmakodynamik von SKY-0515 bei gesunden Probanden und Personen mit Huntington-Krankheit (HD) im Frühstadium zu bewerten. Die Studie ist in drei Teile gegliedert. In den Teilen A und B wurde SKY-0515 bei gesunden Probanden untersucht. Teil C ist eine doppelblinde, placebokontrollierte Parallelstudie mit zwei Dosisstufen von SKY-0515 und Placebo bei Personen mit HD im Frühstadium (HD-ISS Stadium 1, 2 oder mildes Stadium 3) über einen Zeitraum von 84 Tagen, gefolgt von einer 12-monatigen Verlängerung der aktiven Behandlung, bei der alle Teilnehmer verblindet entweder eine niedrige oder eine hohe Dosis von SKY-0515 erhalten. Zu den Zielen der Studie gehört die Untersuchung des mutierten HTT-Proteins und der PMS1-mRNA. Die ersten Patienten wurden in Teil C von SKY-0515 im Januar 2025 behandelt. Die Rekrutierung für die Phase 1C der SKY-0515-Studie ist nun abgeschlossen. Informationen zur klinischen Phase-2/3-Studie FALCON-HD von SKY-0515
FALCON-HD (NCT06873334) ist eine randomisierte, doppelblinde, placebokontrollierte, dosisabhängige Phase-2/3-Studie zur Untersuchung der Pharmakodynamik, Sicherheit und Wirksamkeit von SKY-0515 bei 120 Teilnehmern mit HD im Stadium 2 und frühen Stadium 3 an 12 Standorten in Australien und Neuseeland sowie bei 400 Teilnehmern mit HD im Stadium 2 und frühen Stadium 3 an über 40 Standorten weltweit. Die teilnahmeberechtigten Patienten erhalten einmal täglich eine orale Dosis von SKY-0515 in einer von drei Dosierungen oder Placebo über einen Behandlungszeitraum von mindestens 12 Monaten. Die Studie zielt darauf ab, das Potenzial von SKY-0515 zur Modulation des RNA-Spleißens und zur Verringerung der mHTT- und PMS1-Proteine zu bewerten, die in die Pathologie der Huntington-Krankheit involviert sind. Weitere Informationen zu FALCON-HD, einschließlich teilnehmender Einrichtungen und Zulassungskriterien, finden Sie unter ClinicalTrials.gov und www.FALCON-HD.com. Informationen zu Skyhawk Therapeutics
Skyhawk Therapeutics ist ein Biotechnologieunternehmen im klinischen Stadium, das seine firmeneigene Plattform SKYSTAR® nutzt, um niedermolekulare RNA-modulierende Therapien für die schwierigsten Krankheiten der Welt zu entdecken und zu entwickeln. Weitere Informationen finden Sie unter www.skyhawktx.com. Skyhawk Kontakt
Maura McCarthy
Leiterin der Unternehmensentwicklung
[email protected] Foto – https://mma.prnewswire.com/media/2870056/Skyhawk_Therapeutics_9_MONTH_DATA_Graph.jpg
Logo – https://mma.prnewswire.com/media/710814/Skyhawk_Therapeutics_Logo.jpg

Source link














Leave a Reply