– Skyhawk Therapeutics anuncia resultados provisionales de nueve meses en pacientes de su ensayo clínico de fase 1 de SKY-0515 como tratamiento para la enfermedad de Huntington
El ensayo clínico de fase 1 de SKY-0515 es el primero en humanos, diseñado para evaluar la seguridad, la tolerabilidad, la farmacocinética y la farmacodinámica de SKY-0515 en voluntarios sanos y en personas con enfermedad de Huntington (EH) en fase temprana. El ensayo consta de tres partes. Las partes A y B evaluaron SKY-0515 en voluntarios sanos. La parte C es un estudio paralelo, doble ciego y controlado con placebo, con dos dosis de SKY-0515 y placebo en personas con EH en fase temprana (EH-ISS en fase 1, 2 o fase 3 leve) durante 84 días, seguido de una extensión de 12 meses de tratamiento activo, en el que todos los participantes recibirán una dosis baja o alta de SKY-0515 de forma ciega. Los objetivos del estudio incluyen la evaluación de la proteína HTT mutante y del ARNm de PMS1. Los primeros pacientes recibieron la dosis de la Parte C de SKY-0515 en enero de 2025. La inscripción en la Fase 1C del ensayo SKY-0515 ya está completa. Acerca del estudio clínico de fase 2/3 FALCON-HD de SKY-0515
FALCON-HD (NCT06873334) es un estudio de fase 2/3, aleatorizado, doble ciego, controlado con placebo y de rango de dosis para evaluar la farmacodinamia, la seguridad y la eficacia de SKY-0515 en 120 participantes con EH en estadio 2 y estadio 3 temprano en 12 centros de Australia y Nueva Zelanda, y en 400 participantes con EH en estadio 2 y estadio 3 temprano en más de 40 centros de todo el mundo. Los pacientes elegibles recibirán una dosis oral diaria de SKY-0515 en uno de tres niveles de dosis o placebo, durante un período de tratamiento de al menos 12 meses. El ensayo tiene como objetivo evaluar el potencial de SKY-0515 para modular el empalme del ARN y reducir las proteínas mHTT y PMS1, implicadas en la patología de la enfermedad de Huntington. Puede encontrar más información sobre FALCON-HD, incluyendo los centros participantes y los criterios de elegibilidad, en ClinicalTrials.gov y www.FALCON-HD.com. Acerca de Skyhawk Therapeutics
Skyhawk Therapeutics es una empresa de biotecnología en fase clínica que utiliza su plataforma patentada, SKYSTAR®, para descubrir y desarrollar terapias moduladoras de ARN de moléculas pequeñas para las enfermedades más difíciles de tratar. Para más información, visite www.skyhawktx.com. Contacto de Skyhawk
Maura McCarthy
Directora de Desarrollo Corporativo
[email protected] Foto – https://mma.prnewswire.com/media/2870056/Skyhawk_Therapeutics_9_MONTH_DATA_Graph.jpg
Logo – https://mma.prnewswire.com/media/710814/Skyhawk_Therapeutics_Logo.jpg
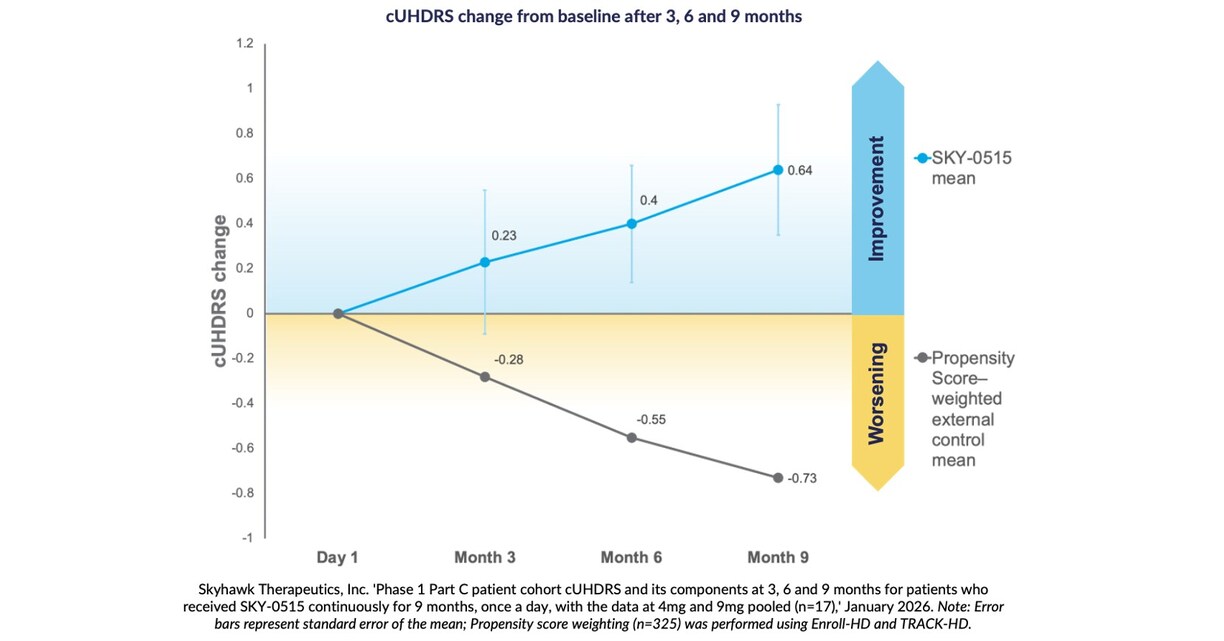
Los resultados a nueve meses muestran una mejora media en la Escala de Calificación Unificada Compuesta de la Enfermedad de Huntington desde el inicio de +0,64 puntos, en comparación con el empeoramiento esperado de la historia natural de la cUHDRS en pacientes sintomáticos de -0,73 puntos a lo largo de nueve meses, según la ponderación de la puntuación de propensión.
Skyhawk también anuncia la expansión mundial del ensayo FALCON-HD de fase 2/3 de SKY-0515. Skyhawk ya ha administrado dosis a más de 90 pacientes.
BOSTON, 27 de enero de 2026 /PRNewswire/ — Skyhawk Therapeutics, Inc., una compañía de biotecnología en etapa clínica que desarrolla nuevas terapias de moléculas pequeñas para modular objetivos críticos de ARN, anunció hoy resultados positivos del análisis provisional de nueve meses del tratamiento en investigación de la compañía para la enfermedad de Huntington (EH) con SKY-0515. El tratamiento con SKY-0515 produce reducciones dependientes de la dosis de la proteína mHTT en sangre del 62 % con la dosis de 9 mg, y una reducción dependiente de la dosis del ARNm de PMS1 del 26 %. PMS1 es un factor clave en la expansión de repeticiones CAG somáticas y la patología de la EH. SKY-0515 también ha demostrado una excelente exposición al sistema nervioso central y, en general, ha sido seguro y bien tolerado. A los tres, seis y nueve meses, los pacientes que recibieron SKY-0515 en la cohorte de pacientes de la Parte C del ensayo clínico de fase 1 de SKY-0515 mostraron una mejoría media en la Escala Unificada Compuesta de Calificación de la Enfermedad de Huntington (cUHDRS) con respecto al inicio. A los nueve meses, en un análisis agrupado, esta mejoría fue de +0,64 puntos, en comparación con el empeoramiento esperado a los nueve meses de la cUHDRS en pacientes sintomáticos de -0,73 puntos, según la ponderación por puntuación de propensión con Enroll-HD y TRACK-HD. “Me siento muy alentado por estos datos iniciales de seguridad y eficacia del ensayo de Fase 1 Parte C de SKY-0515 en pacientes, que muestran una divergencia en la cUHDRS que se aleja del deterioro esperado de la historia natural en los análisis preespecificados a los tres, seis y nueve meses”, afirmó Ed Wild, profesor de Neurología del University College de Londres. “SKY-0515 continúa reduciendo la proteína mHTT en la mayor medida demostrada por cualquier terapia probada hasta la fecha en pacientes, con datos clínicos y de biomarcadores que muestran que el fármaco es bien tolerado en todas las dosis probadas. La capacidad de SKY-0515 para reducir tanto la mHTT como el PMS1 ofrece una potente combinación para el tratamiento de la enfermedad de Huntington a través de dos de sus mecanismos patogénicos principales. Estos resultados de un ensayo abierto, que se validarán en el ensayo FALCON-HD, controlado con placebo y en curso, permiten esperar un impacto significativo para las personas con EH en todo el mundo, para quienes un tratamiento oral para reducir la huntingtina, como SKY-0515, será verdaderamente transformador”. “Nuestro objetivo en el estudio de Fase 1 era establecer la seguridad y la actividad de los biomarcadores”, afirmó Sergey Paushkin, director de I+D de Skyhawk Therapeutics. “La sólida respuesta de SKY-0515 a los biomarcadores en nuestro análisis de datos provisionales de nueve meses, así como la mejora del posible criterio de valoración, cUHDRS, en comparación con un empeoramiento de la puntuación de cUHDRS en los datos de evolución natural de los pacientes, subrayan el potencial de SKY-0515 como la mejor terapia modificadora de la enfermedad para la EH. Estos datos provisionales representan un hito importante para SKY-0515 y resaltan la capacidad de la plataforma de Skyhawk para ofrecer moléculas pequeñas de primera clase para enfermedades devastadoras sin terapias modificadoras de la enfermedad aprobadas”. La enfermedad de Huntington es un trastorno neurodegenerativo poco común, hereditario y, en última instancia, mortal que afecta a más de 40.000 pacientes sintomáticos en Estados Unidos, y se estima que cientos de miles de ellos lo padecen en todo el mundo. Actualmente no existen tratamientos aprobados que ralenticen o detengan la progresión de la enfermedad. SKY-0515 es un modulador de ARN de molécula pequeña en investigación, administrado por vía oral, desarrollado a través de SKYSTAR®, la novedosa plataforma de modulación de ARN de la compañía. SKY-0515 reduce terapéuticamente tanto la proteína HTT como la proteína PMS1. PMS1 es un factor clave adicional en la expansión de repeticiones somáticas de CAG y la patología de la EH, y debería complementar los beneficios de reducir la HTT mutante. Skyhawk también anuncia hoy que su ensayo SKY-0515 de fase 2/3 FALCON-HD, abierto en doce centros de Australia y Nueva Zelanda, se ha expandido a nivel mundial. Skyhawk ya ha administrado SKY-0515 a más de 90 pacientes. SKY-0515 es el primer fármaco de Skyhawk en ensayos clínicos. Skyhawk espera poner a disposición de los pacientes medicamentos de moléculas pequeñas adicionales para tratar enfermedades neurológicas raras sin terapias modificadoras de la enfermedad aprobadas en la clínica para finales de 2027. Acerca del estudio clínico de fase 1 de SKY-0515El ensayo clínico de fase 1 de SKY-0515 es el primero en humanos, diseñado para evaluar la seguridad, la tolerabilidad, la farmacocinética y la farmacodinámica de SKY-0515 en voluntarios sanos y en personas con enfermedad de Huntington (EH) en fase temprana. El ensayo consta de tres partes. Las partes A y B evaluaron SKY-0515 en voluntarios sanos. La parte C es un estudio paralelo, doble ciego y controlado con placebo, con dos dosis de SKY-0515 y placebo en personas con EH en fase temprana (EH-ISS en fase 1, 2 o fase 3 leve) durante 84 días, seguido de una extensión de 12 meses de tratamiento activo, en el que todos los participantes recibirán una dosis baja o alta de SKY-0515 de forma ciega. Los objetivos del estudio incluyen la evaluación de la proteína HTT mutante y del ARNm de PMS1. Los primeros pacientes recibieron la dosis de la Parte C de SKY-0515 en enero de 2025. La inscripción en la Fase 1C del ensayo SKY-0515 ya está completa. Acerca del estudio clínico de fase 2/3 FALCON-HD de SKY-0515
FALCON-HD (NCT06873334) es un estudio de fase 2/3, aleatorizado, doble ciego, controlado con placebo y de rango de dosis para evaluar la farmacodinamia, la seguridad y la eficacia de SKY-0515 en 120 participantes con EH en estadio 2 y estadio 3 temprano en 12 centros de Australia y Nueva Zelanda, y en 400 participantes con EH en estadio 2 y estadio 3 temprano en más de 40 centros de todo el mundo. Los pacientes elegibles recibirán una dosis oral diaria de SKY-0515 en uno de tres niveles de dosis o placebo, durante un período de tratamiento de al menos 12 meses. El ensayo tiene como objetivo evaluar el potencial de SKY-0515 para modular el empalme del ARN y reducir las proteínas mHTT y PMS1, implicadas en la patología de la enfermedad de Huntington. Puede encontrar más información sobre FALCON-HD, incluyendo los centros participantes y los criterios de elegibilidad, en ClinicalTrials.gov y www.FALCON-HD.com. Acerca de Skyhawk Therapeutics
Skyhawk Therapeutics es una empresa de biotecnología en fase clínica que utiliza su plataforma patentada, SKYSTAR®, para descubrir y desarrollar terapias moduladoras de ARN de moléculas pequeñas para las enfermedades más difíciles de tratar. Para más información, visite www.skyhawktx.com. Contacto de Skyhawk
Maura McCarthy
Directora de Desarrollo Corporativo
[email protected] Foto – https://mma.prnewswire.com/media/2870056/Skyhawk_Therapeutics_9_MONTH_DATA_Graph.jpg
Logo – https://mma.prnewswire.com/media/710814/Skyhawk_Therapeutics_Logo.jpg

Source link












Leave a Reply