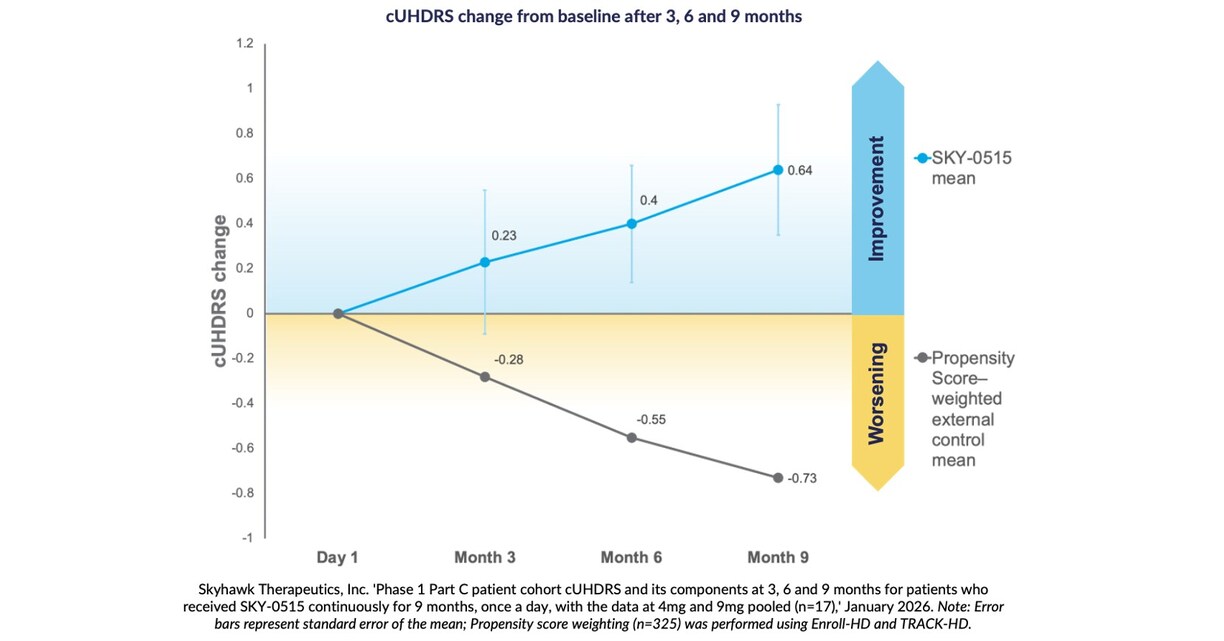
Les résultats sur neuf mois montrent une amélioration moyenne de l’échelle d’évaluation unifiée pour la maladie de Huntington par rapport au point de référence de +0,64 point, comparativement à une aggravation prévue naturelle de la cUHDRS chez les patients symptomatiques de -0,73 point sur neuf mois, selon la pondération des scores de propension.
Skyhawk annonce également que l’essai de phase 2/3 FALCON-HD de SKY-0515 s’est étendu au monde entier. Skyhawk a maintenant administré des doses à plus de 90 patients.
BOSTON, 28 janvier 2026 /PRNewswire/ — Skyhawk Therapeutics, Inc., société de biotechnologie au stade clinique qui met au point de nouvelles thérapies à petites molécules pour moduler les cibles critiques d’ARN, annonce aujourd’hui les résultats positifs de l’analyse intermédiaire à neuf mois du traitement expérimental mis au point par la Société contre la maladie de Huntington (HD) avec SKY-0515. Le traitement avec SKY-0515 entraîne une réduction de 62 %, proportionnelle à la dose administrée, de la protéine mHTT dans le sang à la dose de 9 mg et une réduction de 26 %, elle aussi proportionnelle à la dose administrée, de l’ARNm PMS1. Le PMS1 est un facteur clé de l’expansion répétée d’un trinucléotide CAG somatique et de la pathologie de la maladie de Huntington. Le SKY-0515 a également démontré une excellente exposition du système nerveux central et était généralement sûr et bien toléré. Après trois, six et neuf mois, les patients recevant le SKY-0515 choisis parmi la cohorte de patients de la Partie C de l’essai clinique en Phase 1 du SKY-0515, montrent une amélioration moyenne de l’échelle d’évaluation unifiée pour la maladie de Huntington (cUHDRS) par rapport au niveau de référence. À neuf mois, dans le cadre d’une analyse groupée, cette amélioration est de +0,64 point par rapport à l’aggravation prévue à neuf mois de la cUHDRS chez les patients symptomatiques de -0,73 point, selon la pondération des scores de propension à l’aide de Enroll-HD et de TRACK-HD. « Ces données relatives à l’innocuité et à l’efficacité précoce de l’essai de Phase 1, Partie C, du SKY-0515 chez les patients sont très encourageantes, car ils montrent un écart dans la cUHDRS par rapport à la détérioration naturelle prévue lors des analyses prédéfinies à trois, six et neuf mois », a déclaré Ed Wild, professeur de neurologie à l’University College de Londres. « Le SKY-0515 continue de réduire la protéine mHTT dans toute la mesure démontrée par tous les traitements testés à ce jour chez les patients, les données cliniques et les données de biomarqueurs montrant que le médicament est bien toléré à toutes les doses testées. La capacité du SKY-0515 à réduire tant la mHTT que le PMS1 offre une combinaison efficace pour traiter la maladie de Huntington au moyen de deux de ses principaux mécanismes pathogènes. Ces résultats d’essais ouverts, qui doivent être validés dans le cadre de l’essai FALCON-HD en cours contrôlé par placebo, suscitent l’espoir d’un impact significatif pour les personnes vivant avec la maladie de Huntington partout dans le monde et pour lesquelles un traitement administré par voie orale comme le SKY-0515 sera véritablement révolutionnaire ». « Dans le cadre de notre essai de Phase 1, il s’agissait d’établir l’innocuité et l’activité des biomarqueurs », a déclaré Sergey Paushkin, chef de R&D chez Skyhawk Therapeutics, « et la force de réponse des biomarqueurs SKY-0515 constatée dans notre analyse intermédiaire des données à neuf mois, ainsi que l’amélioration du critère potentiel cUHDRS par rapport à une aggravation du score cUHDRS dans les données naturelles des patients, souligne le potentiel de SKY-0515 en tant que meilleur traitement modificateur de la maladie de la catégorie pour la maladie de Huntington. Ces données intermédiaires sont une étape importante pour SKY-0515 et soulignent l’énorme capacité de la plateforme Skyhawk à fournir de petites molécules, premières du genre, pour les maladies graves pour lesquelles aucun traitement modificateur n’a été approuvé ». La maladie de Huntington est un trouble neurodégénératif rare, héréditaire et dont l’issue est fatale, qui touche plus de 40 000 patients symptomatiques aux États-Unis et des centaines de milliers dans le monde entier. Il n’existe actuellement aucun traitement approuvé qui ralentit ou interrompt la progression de la maladie. Le SKY-0515 est un modulateur d’ARN expérimental à petites molécules administré par voie orale et mis au point par l’entreprise, SKYSTAR® au moyen de sa nouvelle plateforme de modulation de l’ARN. Le SKY-0515 réduit de façon thérapeutique à la fois la protéine HTT et la protéine PMS1. La PMS1 est un autre facteur clé de l’expansion répétée d’un trinucléotide CAG somatique et de la pathologie de la maladie de Huntington et devrait compléter les avantages de la réduction du HTT mutant. Skyhawk annonce également aujourd’hui que son essai SKY-0515 en Phase 2/3 FALCON-HD, ouvert sur douze sites en Australie et en Nouvelle-Zélande, s’est étendu dans le monde entier. Skyhawk a maintenant administré le SKY-0515 à plus de 90 patients. SKY-0515 est le premier médicament Skyhawk en essais cliniques. Skyhawk prévoit de mettre d’autres médicaments à petites molécules pour traiter les maladies neurologiques rares sans traitement modificateur de la maladie approuvé en essais cliniques d’ici la fin de 2027. À propos de l’essai clinique de Phase 1 de SKY-0515L’essai clinique de Phase 1 de SKY-0515 est un premier essai chez l’humain visant à évaluer l’innocuité, la tolérabilité, la pharmacocinétique et la pharmacodynamique du SKY-0515 chez des volontaires en bonne santé et chez des personnes atteintes de la maladie de Huntington à un stade précoce. L’essai est séparé en trois parties. Les parties A et B ont évalué le SKY-0515 chez les volontaires en bonne santé. La partie C est un essai de conception parallèle en double aveugle contre placebo portant sur deux doses de SKY-0515 et de placebo chez les personnes atteintes de la maladie de Huntington à un stade précoce (stade 1, 2 ou stade léger 3) pendant 84 jours, suivie d’une prolongation de 12 mois du traitement actif où tous les participants recevront une dose faible ou élevée de SKY-0515 à l’aveugle. L’essai a pour objet d’évaluer la protéine mutante HTT et l’ARNm PMS1. Les doses de la partie C du SKY-0515 ont été administrées aux premiers patients en janvier 2025. L’inscription à la phase 1C de l’essai SKY-0515 est maintenant terminée. À propos de l’essai clinique FALCON-HD de Phase 2/3 du SKY-0515
FALCON-HD (NCT06873334) est un essai de dosage de Phase 2/3 en double aveugle, contre placebo, qui vise à évaluer la pharmacodynamique, l’innocuité et l’efficacité du SKY-0515 chez 120 participants atteints de la maladie de Huntington au stade 2 et au stade 3 précoce dans 12 sites en Australie et en Nouvelle-Zélande, et 400 participants atteints de la maladie de Huntington au stade 2 et au stade 3 précoce dans plus de 40 sites à l’échelle mondiale. Les patients admissibles recevront une dose par voie orale de SKY-0515 une fois par jour à l’un des trois niveaux de dose ou un placebo, pendant une période de traitement d’au moins 12 mois. L’essai vise à évaluer le potentiel du SKY-0515 pour moduler l’épissage des ARN et réduire les protéines mHTT et PMS1, qui sont impliquées dans la pathologie de la maladie de Huntington. Vous trouverez de plus amples renseignements sur FALCON-HD, y compris les sites participants et les critères d’admissibilité, sur ClinicalTrials.gov et www.FALCON-HD.com. À propos de Skyhawk Therapeutics
Skyhawk Therapeutics est une société de biotechnologie au stade clinique qui utilise sa plateforme exclusive, SKYSTAR®, pour découvrir et développer des thérapies de modulation d’ARN à petites molécules pour les maladies les plus graves au monde. Pour plus d’informations, consultez le site www.skyhawktx.com. Contact Skyhawk
Maura McCarthy
Directrice du développement de l’entreprise
[email protected] Photo – https://mma.prnewswire.com/media/2870056/Skyhawk_Therapeutics_9_MONTH_DATA_Graph.jpg
Logo – https://mma.prnewswire.com/media/710814/Skyhawk_Therapeutics_Logo.jpg

Source link














Leave a Reply